mai 16, 2023
Philips fornece atualização sobre o conjunto completo de resultados de testes para dispositivos de terapia do sono CPAP/BiPAP
Amsterdã, Holanda — A Royal Philips (NYSE: PHG, AEX: PHIA), fornece hoje uma atualização sobre o programa abrangente de testes e pesquisas de sua subsidiária, a Philips Respironics, para avaliar potenciais riscos à saúde relacionados à espuma para redução de som de poliuretano à base de poliéster (PE-PUR) em dispositivos para terapia do sono e ventilação especificados no aviso de segurança/notificação de recall voluntário de junho de 2021.*
As avaliações de risco dos dispositivos de terapia do sono CPAP/BiPAP já foram concluídas cincluídos na notificação de recall/aviso de segurança, ou seja, referentes aos dispositivos DreamStation, System One e DreamStation Go de primeira geração, representando aproximadamente 95% dos dispositivos registrados no mundo todo. As avaliações se baseiam nas atualizações anteriores em dezembro de 2021, junho de 2022 e dezembro de 2022. Além disso, foram realizados testes e análises nos dispositivos DreamStation de primeira geração expostos à limpeza com ozônio.
Métodos de teste
O programa de testes e pesquisas foi conduzido em conjunto com cinco laboratórios de teste independentes e certificados, e os resultados foram analisados e avaliados por especialistas qualificados terceiros e pela Philips Respironics, bem como por um painel médico externo.
Os métodos de testes aplicados, que compreendem o planejamento dos testes, a execução dos testes e a interpretação dos resultados das avaliações de riscos concluídas, estão em conformidade com as normas aplicáveis do setor ISO 18562 [1,2] e ISO 10993 [2]. A concepção dos métodos de testes aplicados foi ainda cientificamente fundamentada numa consideração exaustiva e na atenuação das limitações inerentes aos testes. Por exemplo, foram realizados testes em vários dispositivos usados, com diferentes níveis de uso pelo paciente e degradação visual da espuma observada, e em espuma envelhecida em laboratório, que foi intencionalmente degradada em diferentes graus. Pressupostos bem conservadores foram incluídos nas avaliações de risco. Demais exemplos são apresentados na parte inferior deste comunicado de imprensa.
"Nossa primeira prioridade é a saúde e o bem-estar dos pacientes", disse Roy Jakobs, CEO da Royal Philips. "Por isso, focamos no amplo programa de testes e pesquisas para obter mais clareza sobre a segurança dos dispositivos afetados e no fornecimento de dispositivos de substituição aos pacientes. As avaliações de risco de terceiros dos dispositivos de terapia do sono apresentadas hoje são positivas e tranquilizadoras, e o nosso processo de correção dos dispositivos afetados vem progredindo bem. As autoridades competentes globalmente, incluindo a FDA, ainda estão analisando os resultados dos testes e das avaliações. Compartilhamos o mesmo objetivo de garantir a segurança e a qualidade para os pacientes na prestação de cuidados médicos e continuamos empenhados em trabalhar em estreita colaboração com essas agências. A conclusão dos testes e a correção dos dispositivos afetados continuam sendo nossas maiores prioridades."
Resultados de testes e análises de dispositivos de terapia do sono não expostos à limpeza com ozônio
O conjunto completo de resultados de testes e análises da primeira geração de dispositivos de terapia do sono DreamStation, System One e DreamStation Go indica indica que é improvável que a exposição potencial do paciente a material particulado (MP) e compostos orgânicos voláteis (VOCs) da espuma PE-PUR dentro desses dispositivos resulte em danos consideráveis à saúde dos pacientes. Os testes realizados e as conclusões foram resumidos na tabela abaixo.
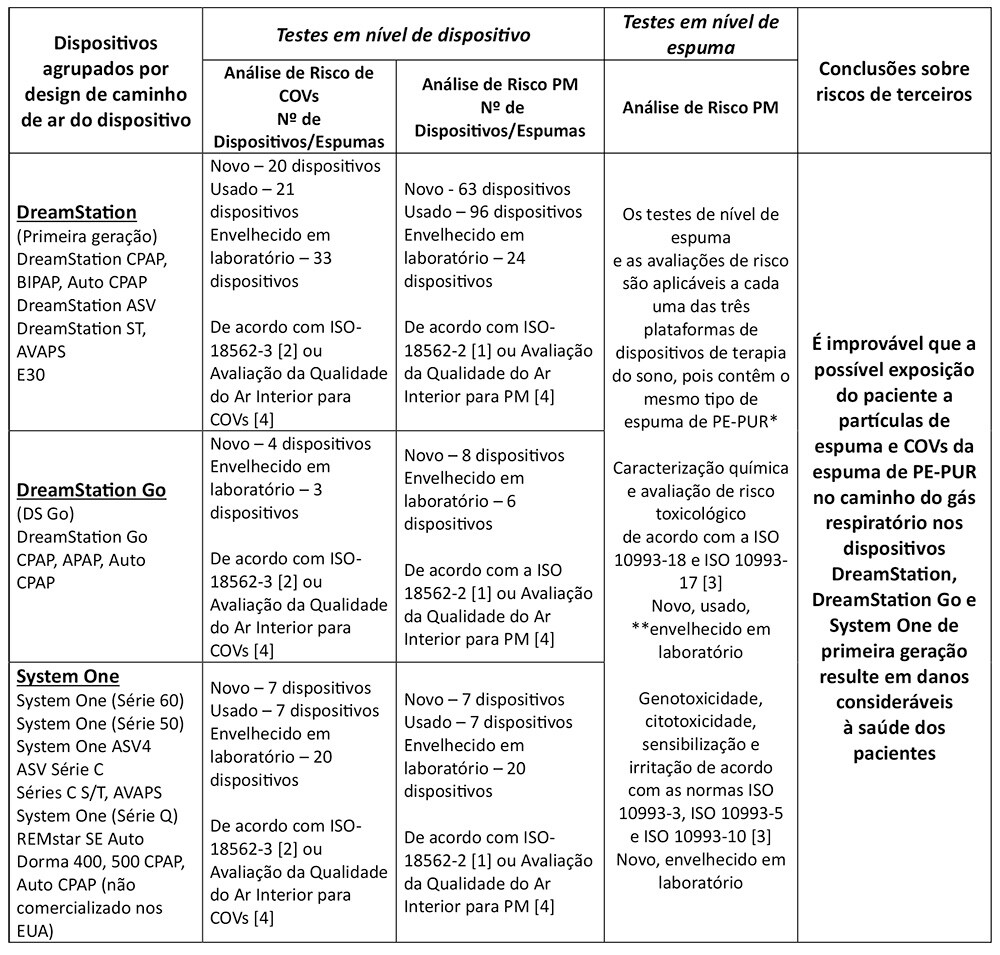
COV:compostos orgânicos voláteis MP: material particulado * A quantidade total de espuma nos dispositivos varia de aproximadamente 1 g a 10 g, dependendo do design e da configuração da passagem do ar do dispositivo. Os dispositivos dentro de cada plataforma compartilham o mesmo design e configuração de passagem de ar, bem como a mesma quantidade de espuma presente. ** A espuma de sete dispositivos DreamStation diferentes usados de primeira geração foi caracterizada quimicamente de acordo com as normas ISO 10993-18 e -17 [3] e incluiu espuma que representa uma variedade de estados de degradação visual.
Testes expandidos e avaliações de risco toxicológico em vários dispositivos com espuma nova, usada e envelhecida em laboratório não mostraram danos significativos à saúde relacionados aos COVs detectados com base nos testes ISO 18562-3 [2], enquanto uma avaliação de risco de terceiros concluiu que é improvável que a exposição a COVs nesses dispositivos resulte em um dano significativo à saúde dos pacientes.
Dispositivos novos, envelhecidos em laboratório e usados foram testados e todos estavam em conformidade com os limites permitidos pela ISO 18562-2 [1] para as emissões de MP. Os testes foram realizados em dispositivos usados (ou seja, dispositivos usados anteriormente por pacientes) com diferentes graus de degradação (ou seja, de nenhuma à grave degradação visível), dispositivos novos e dispositivos com espuma envelhecida em laboratório que foram expostos intencionalmente a temperaturas (≥80 °C) e umidade (≥75% UR) muito altas para acelerar a degradação.
Outras emissões testadas de MP nos dispositivos usados com degradação visível não foram estatisticamente diferentes das emissões de MP de dispositivos usados sem degradação, sugerindo que a degradação não contribuiu para níveis significativamente elevados de partículas inaláveis nos dispositivos testados.
Mesmo com a suposição muito conservadora e teórica de que a espuma pode sofrer degradação e que um paciente é então exposto a toda a espuma degradada de PE-PUR dentro do dispositivo, a avaliação de riscos de terceiros concluiu que é improvável que a exposição a partículas de espuma degradada nesses dispositivos, incluindo possíveis partículas respiráveis e não respiráveis, resulte em um dano significativo à saúde dos pacientes.
Com base na inspeção visual da espuma em dispositivos DreamStation de primeira geração devolvidos, a prevalência de degradação visível da espuma foi baixa. A inspeção visual só pode identificar a degradação visível da espuma e não pode medir a geração de compostos orgânicos voláteis ou quantificar a perda de partículas. Portanto, testes e análises adicionais foram realizados conforme descrito acima e na atualização completa.
O impacto da limpeza com ozônio na degradação da espuma em dispositivos DreamStation de primeira geração
A Philips Respironics concluiu os testes em dispositivos DreamStation de primeira geração expostos à limpeza com ozônio:
Os testes de COV da ISO 18562-3 mostraram que após 200 ciclos de limpeza com ozônio - cada ciclo simulando uma noite de uso e, em seguida, a limpeza com ozônio - o dietilenoglicol (DEG) tornou-se detectável como um COV. Os testes foram realizados até 500 ciclos de limpeza com ozônio, e um risco toxicológico de COV decorrente dessa degradação induzida pelo ozônio determinou que a exposição às emissões de COV dos dispositivos DreamStation de primeira geração avaliados e expostos à limpeza com ozônio não sugere um risco significativo à saúde dos pacientes.
Em relação aos riscos associados a particulados respiráveis e não respiráveis, foram realizados testes até o momento em dispositivos com exposição conhecida ao ozônio. Por exemplo, dois dispositivos DreamStation usados de primeira geração com exposição ao ozônio relatada pelo usuário foram incluídos em testes de extraíveis e lixiviáveis, que formaram a base para uma avaliação de risco toxicológico de espuma particulada PE-PUR do dispositivo de terapia do sono. Essa análise coletiva de terceiros concluiu que é improvável que a exposição a materiais particulados de espuma degradada em dispositivos DreamStation de primeira geração resulte em um dano significativo à saúde dos pacientes.
Como publicado anteriormente, os dados referentes à primeira geração do DreamStation indicam que os dispositivos com limpeza de ozônio relatada pelo usuário apresentam 14 vezes mais chances de apresentar degradação/redução de volume de espuma visíveis significativas em comparação com dispositivos sem exposição ao ozônio relatada pelo usuário. Essa observação é consistente com testes de laboratório, em que os dispositivos DreamStation de primeira geração expostos a ciclos crescentes de limpeza de ozônio tiveram degradação visual cada vez mais severa. No entanto, como concluído acima, é improvável que isso resulte em um dano significativo à saúde dos pacientes.
Resumo dos testes em andamento
A Philips Respironics está em processo de conclusão de vários testes e análises restantes. As avaliações de risco em dispositivos System One e DreamStation Go (que contêm a mesma espuma que os dispositivos DreamStation de primeira geração) limpos com ozônio estão sendo concluídas. Quanto aos ventiladores Trilogy 100/200 e OmniLab Advanced Plus, os testes de COV e MP continuam, bem como a avaliação química e a avaliação de risco toxicológico. Esses dispositivos contêm um tipo diferente de espuma PE-PUR do que os dispositivos DreamStation de primeira geração [5]. A Philips Respironics espera fornecer uma atualização sobre esse quesito no 3º trimestre de 2023.
Orientação para profissionais de saúde e pacientes
Solicitamos aos pacientes que estão usando atualmente um dispositivo de terapia do sono afetado que não tenha sido corrigido nem registrado que registrem seus dispositivos para facilitar a correção.
A Philips Respironics continua aconselhando os pacientes que usam dispositivos de terapia do sono afetados que ainda não tenham sido corrigidos a entrar em contato com o seu médico ou prestador de cuidados para decidir sobre um tratamento adequado para a sua condição, o que pode incluir interromper o uso do dispositivo, continuar usando o dispositivo afetado, usar outro dispositivo semelhante que não faça parte do recall ou usar tratamentos alternativos para apneia do sono. Além disso, aconselhamos os pacientes a seguir as instruções e orientações recomendadas de limpeza e substituição da máquina e dos acessórios e dispositivos de terapia do sono da Philips Respironics. Produtos de limpeza de ozônio e luz UV não são métodos aprovados atualmente para dispositivos ou máscaras para terapia do sono e não devem ser usados.
A Philips Respironics também continua aconselhando os usuários de dispositivos de ventiladores a entrar em contato com seus profissionais de saúde antes de fazer qualquer alteração na terapia.
Fundamentação científica dos métodos de teste
A concepção dos métodos de testes aplicados foi cientificamente fundamentada em uma consideração exaustiva e mitigação das limitações de testes que são inerentes a qualquer norma de testes e/ou investigação científica. Para ilustrar isso, exemplos de tais considerações e mitigações foram listados abaixo.
A base científica dos métodos de testes aplicados incluiu uma consideração exaustiva e a atenuação das limitações dos testes, por exemplo:
Observações * Notificação de recall voluntário nos EUA/aviso de segurança para o restante do mundo. [1] ISO 18562-2: Avaliação da biocompatibilidade das vias de gás respiratório cuidados de saúde – Parte 2: Teste de emissões de material particulado. [2] ISO 18562-3: Avaliação da biocompatibilidade das vias de gás respiratório em aplicações de cuidados de saúde – Parte 3: Testes de emissões de compostos orgânicos voláteis. [3] ISO 10993: Avaliação biológica de dispositivos médicos; Parte 1: Avaliação e testes dentro de um processo de gestão de riscos; Parte 3: Testes de genotoxicidade, carcinogenicidade e toxicidade reprodutiva, Parte 5: Testes de citotoxicidade in vitro; Parte 10: Testes de irritação e sensibilização da pele; Parte 17: Estabelecimento de limites permitidos para substâncias lixiviáveis; Parte 18: Caracterização química de materiais de dispositivos médicos dentro de um processo de gerenciamento de riscos. [4] O padrão adotado nos testes anteriores à ISO 18562. [5] Os dispositivos DreamStation, System One e DreamStation Go de primeira geração contêm espuma PE-PUR tipo A, enquanto os dispositivos Trilogy 100/200 contêm espuma PE-PUR tipo B e os dispositivos OmniLab Advanced Plus contêm espumas PE-PUR tipo A e tipo B. As diferenças conhecidas entre as espumas tipo A e B são que a espuma tipo B pode ser usada com um adesivo acrílico sensível à pressão, tem uma densidade menor, possui uma espessura diferente e também contém um aditivo para reduzir o risco de inflamabilidade.
Sobre a Royal Philips
A Royal Philips (NYSE: PHG, AEX: é uma empresa líder em tecnologia de saúde focada em melhorar a saúde e o bem-estar das pessoas por meio de inovações significativas. A inovação centrada no paciente e nas pessoas da Philips utiliza tecnologia avançada e percepções clínicas e de consumo profundas para oferecer soluções de saúde pessoal para consumidores e soluções de saúde profissional para profissionais de saúde e seus pacientes no hospital e em casa. Com sede na Holanda, a empresa é líder em diagnóstico por imagem, ultrassom, terapia guiada por imagem, monitoramento e informática empresarial, bem como em saúde pessoal. A Philips gerou €17,8 bilhões em vendas no ano de 2022 e emprega cerca de 74 mil funcionários no setor de vendas e serviços, em mais de 100 países. Visite o site www.philips.com/newscenter para obter notícias sobre a Philips.
Declarações prospectivas
Esta declaração inclui determinadas afirmações prospectivas com relação às condições financeiras, resultados de operações e das empresas da Philips e alguns dos planos e objetivos da Philips com relação a esses itens. Exemplos de declarações prospectivas incluem declarações feitas sobre estratégia, estimativas de crescimento de vendas, EBITA futuro, desenvolvimentos futuros nos negócios orgânicos da Philips e conclusão de aquisições e desinvestimentos. Por sua natureza, tais declarações envolvem riscos e incertezas por se relacionarem a eventos e circunstâncias futuras, e muitos fatores podem fazer com que os resultados e avanços reais sejam substancialmente diferentes dos expressos ou implícitos nessas declarações.
Temas
Contactos

Steve Klink
Philips Global Press Office Tel: +31 6 10888824
You are about to visit a Philips global content page
Continue
Elco van Groningen
Philips Global Press Office Tel: +31 6 8103 9584
You are about to visit a Philips global content page
ContinueMaterial gráfico











